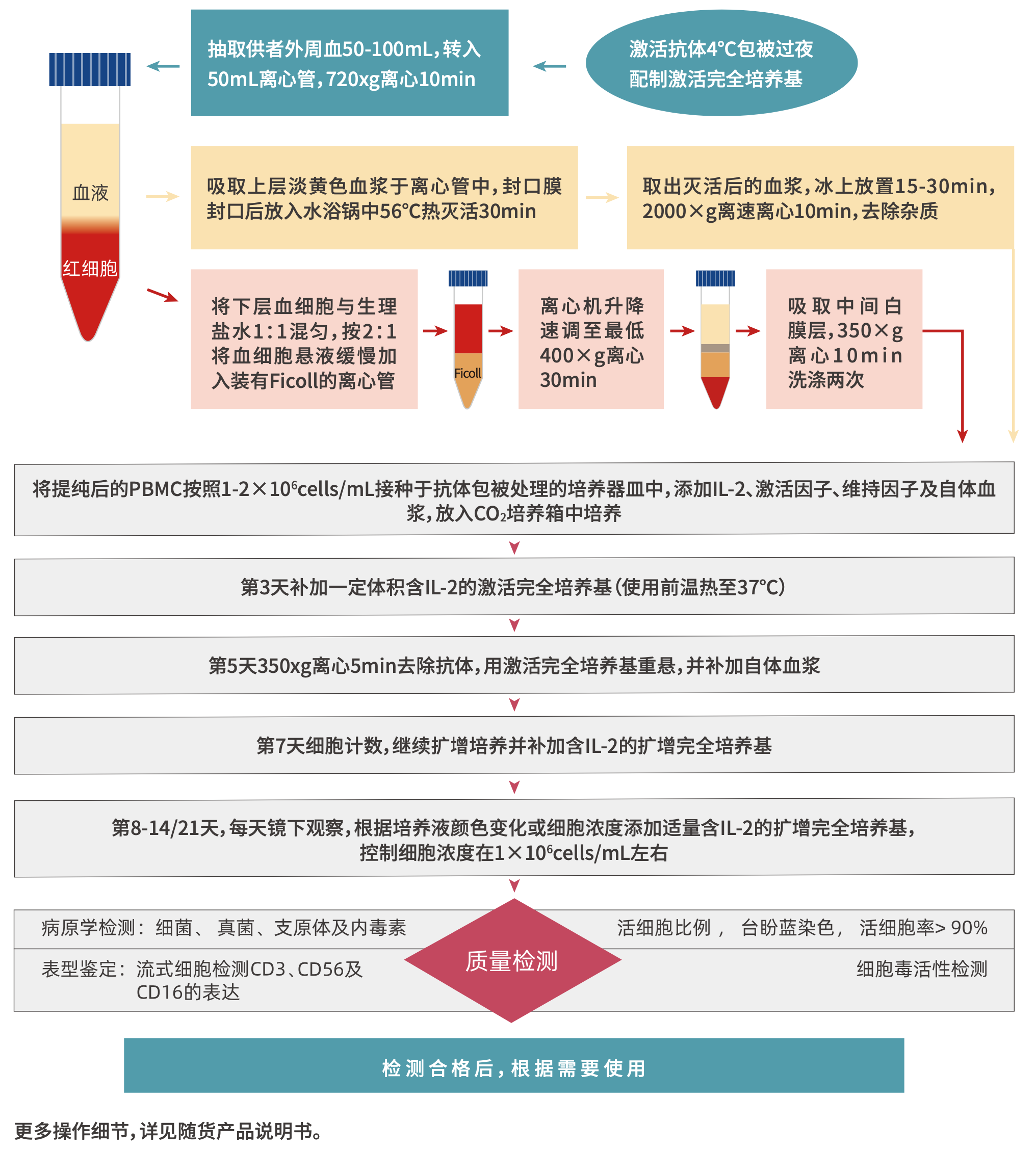
| 应用材料:
采用自体采集的外周血50~100mL,采用细胞计数的方法检测免疫细胞的增殖及细胞倍增时间,用流式检测CD3- CD56+、 CD3+ CD56+、 CD56+CD16+细胞比例。
| 实验材料:
健康自体外周血(肝素采血管), Cyto-NK™试剂盒(含有NK细胞维持因子);
| 实验步骤:(简述)
1) 用肝素采血管采集外周血50~100mL,按照说明书操作。
2) 第3天,显微镜下观察细胞形态后,补加1-2倍体积新鲜激活培养基,继续培养。
3) 第5天,用一次性10ml无菌吸管吸取细胞培养液,轻轻冲洗培养瓶贴壁细胞,尽量回收贴壁细胞。将细胞混悬液移入新的一次性50ml灭菌离心管,取少量计数。离心 350g×5分钟,用NK细胞激活培养液重悬,将细胞密度调整至1×10^6 cells/mL,按照容积比6%添加自体血浆,继续培养。
4) 第6天,镜下观察,适量补加新鲜激活培养基,并按照补液体积5%左右补加自体血浆。
5) 第7天,补加上述新鲜扩瓶培养基,血清终浓度控制在2%左右。
6) 第8-20天,根据镜下观察及培基颜色变化,补加新鲜扩瓶培养基。
7) 第21天收获细胞。
8) 整个扩增过程中0、14、21天计数,统计细胞增殖情况,培养14、21天取部分细胞进行流式表型检测。
| 实验结果:
检测方法:健康人的PBMC细胞按产品说明书进行细胞培养。细胞培养至14天/21天收获,进行细胞计数和检测。细胞使用CD3 APC / CD56 PE / CD16 FITC抗体孵育后进行流式检测。
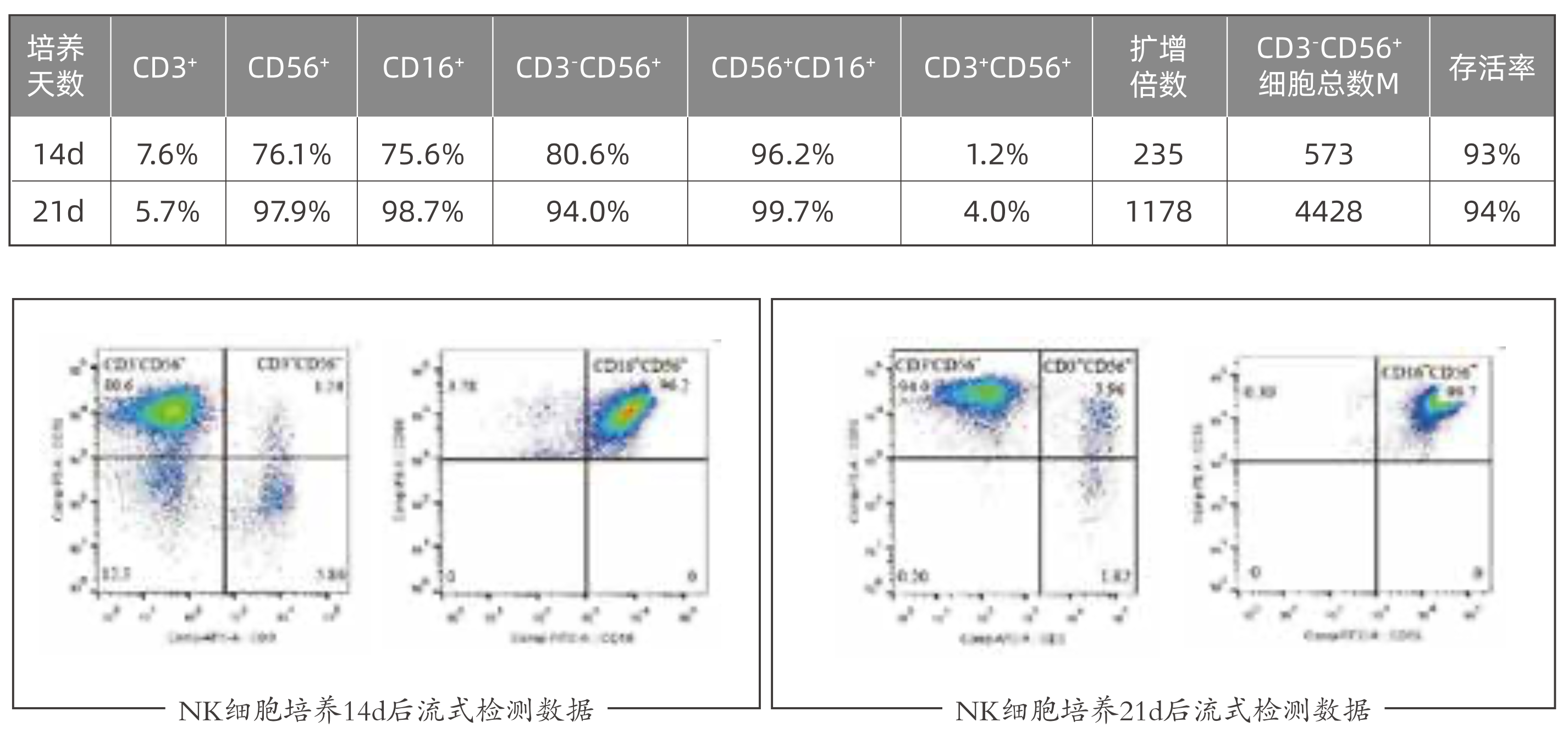
| 技术指标:
培养 14 天后,细胞数量达到 2~8×10^9 cells 以上,则可根据需求安排使用,也冻存后 放入液氮保存,待检测合格后安排使用。
注意:
1. 细胞培养第 14 天,一般 CD3-CD56+>75%,CD56+>80%,CD16+>85%,扩增倍数200 倍;
2. 细胞培养第 21 天,一般 CD3-CD56+ >85%,CD56+>85%,CD16+>90%,扩增倍数300~500 倍。
3. 由于个体样本存在差异,不同样品建议根据实际情况选择培养时间,收获细胞。